Översikt över registrerings- och rapporteringsprocessen
Processen för registrering och rapportering av resultat för kliniska läkemedelsprövningar och kliniska studier vid Karolinska Institutet (KI) baseras på specifika regler och krav som fastställts av nationella och internationella institutioner, etiska skyldigheter och kliniska prövningsregister. Det vanligaste prövningsregistret för registrering av kliniska studier är ClinicalTrials.gov medan alla kliniska läkemedelsprövningar registreras i CTIS.
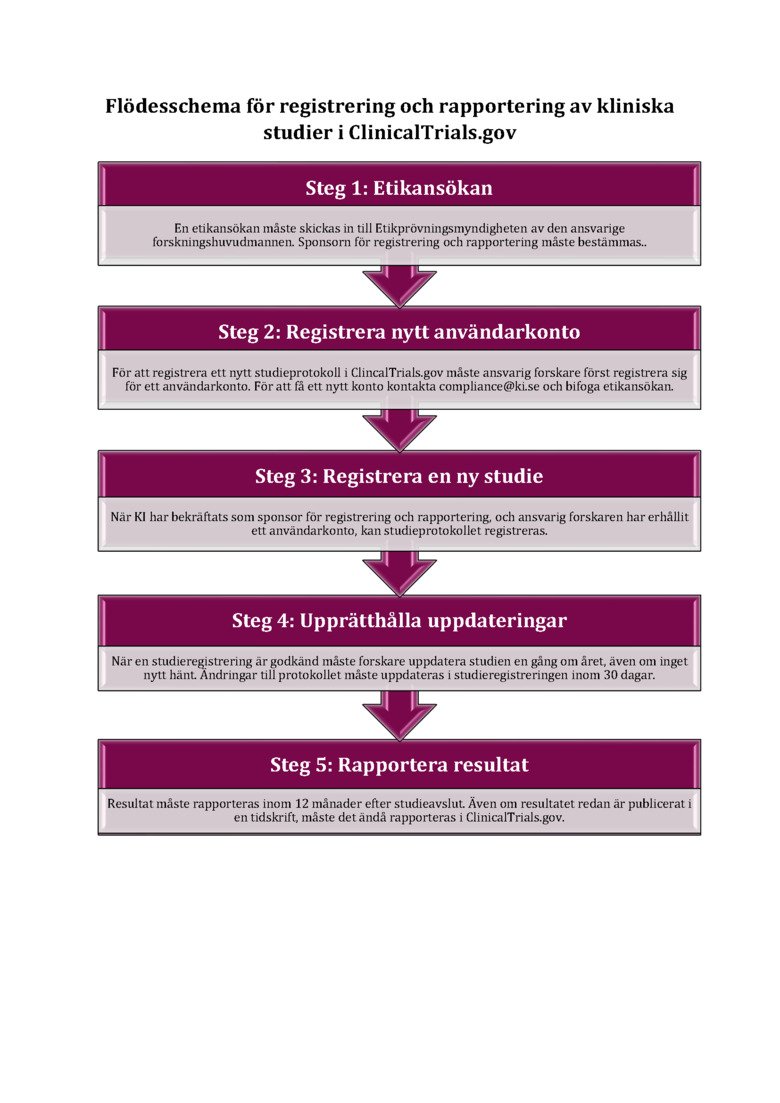
ClinicalTrials.gov
Nedan är ett flödesschema med en kort beskrivning över de olika stegen för att registrera en klinisk studie i ClinicalTrials.gov. För mer detaljerad information om varje steg, se vår sida om ClinicalTrials.gov.
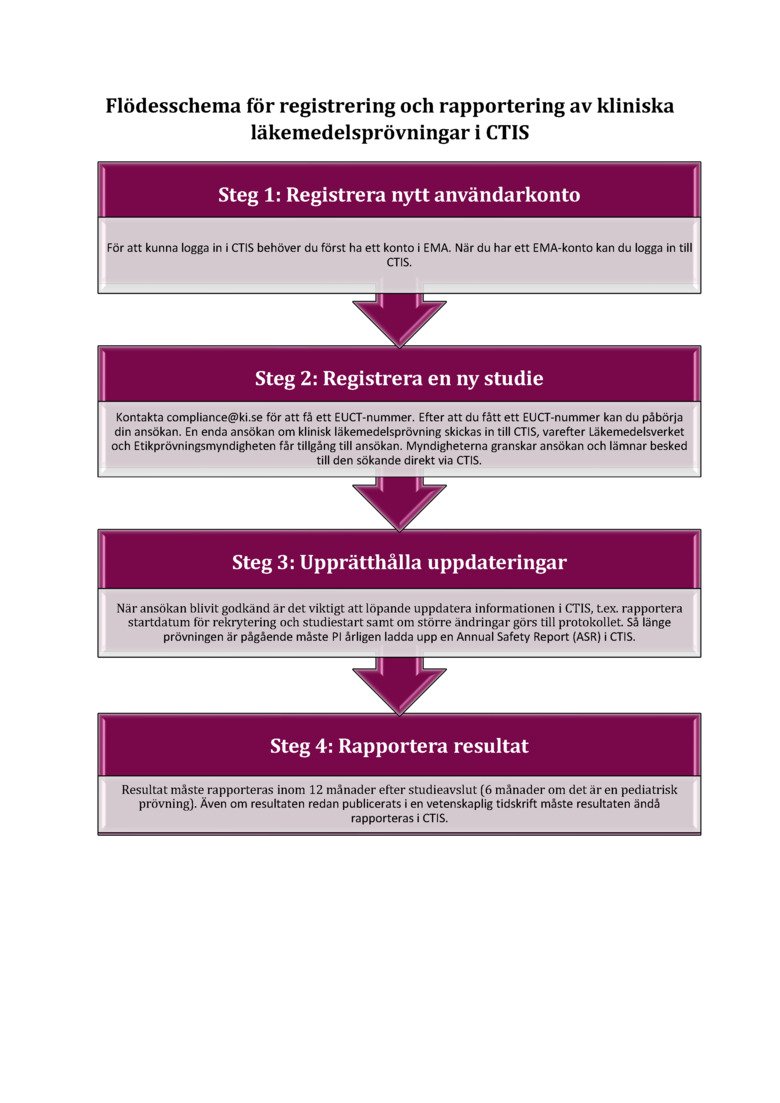
CTIS
Nedan är ett flödesschema med en kort beskrivning över de olika stegen för att registrera en klinisk läkemedelsprövning i CTIS. För mer detaljerad information om varje steg, se vår sida om CTIS.